

Articulo de investigación
1Universidad Técnica de Machala; Machala - Ecuador; CP 070211
2Ministerio de Ambiente, Agua y Transición Ecológica; Machala – Ecuador CP 070151
El cangrejo rojo Ucides occidentalis es una especie clave que funciona como bioindicador de la
salud del
ecosistema manglar. El presente estudio evalúa la relación entre las características morfométricas,
diversidad y salud de este ecosistema a través del análisis de correlación de Pearson en 2 islas del
archipiélago de Jambelí. El trabajo se realizó en conjunto con recolectores de cangrejos de la
Asociación 15 de enero, quienes proporcionaron datos sobre los sitios de captura. Se analizaron datos de
densidad poblacional, encontrando diferencia significativa entre los sitios; Chupadores es el más
abundante con una densidad de10 ind /10m2. La correlación entre ancho y largo del cefalotórax es
positiva, pero debil (r= 0.32, p < 0.001), lo que indica que las variables no están directamente
relacionadas, pero pueden influenciarse de manera mínima. Esta relación puede estar puede estar
sujeta a factores como épocas climáticas; mientras que la relación entre el tamaño de cefalotórax de
U. Occidentalis con el NDVI mostro una relación directa porque demuestra que en lugares como
San
Gregorio que cuenta con baja cobertura vegetal y predominancia del sector camaronero, existe menor
abundancia y tamaño de cefalotórax en U. Occidentallis.
Palabras clave: Densidad poblacional, tamaño, cefalotórax, NDVI, correlación
The red crab Ucides occidentalis is a key species that serves as a bioindicator of the health of the
mangrove ecosystem. This study evaluates the relationship between the morphometric characteristics,
diversity, and health of this ecosystem through Pearson's correlation analysis on two islands in the
Jambelí archipelago. The work was carried out in conjunction with crab collectors from the 15 de enero
Association, who provided data on capture sites. Population density data were analysed, finding a
significant difference between sites; Chupadores is the most abundant with a density of 10 ind/10m2. The
correlation between cephalothorax width and length is positive but weak (r= 0.32, p < 0.001),
indicating
that the variables are not directly related but may influence each other minimally. This
relationship may be subject to factors such as climatic conditions, while the relationship between
the cephalothorax size of U. Occidentalis and NDVI showed a direct relationship because it
demonstrates that in places such as San Gregorio, which has low vegetation cover and a predominance
of the shrimp sector, there is less abundance and cephalothorax size in U. Occidentallis
Keywords: Population density, size, cephalothorax, NDVI, correlation.
Los manglares son ecosistemas altamente productivos que proporcionan servicios ecológicos significativos, actuando como barreras naturales de protección contra eventos climáticos extremos, y mitigando factores como la energía de las olas, marejadas, corrientes, erosión de sedimentos y flujo de agua. Estos ecosistemas reducen la magnitud y alcance de dichos factores, disminuyendo su impacto en las zonas costeras [1, 2]. Así mismo, estos ambientes son objeto de exhaustivos estudios ya que abarcan entre el 60% y 75 % de las costas tropicales a nivel mundial debido a su relevancia ecológica y económica [3,4].
En los ecosistemas de mangle, las raíces arbóreas cumplen una función esencial al proporcionar refugio y sustento para una diversidad de especies como invertebrados, peces y moluscos [5]. Entre estas especies el cangrejo rojo (Ucides occidentalis) de la familia Ucididae se encuentra ampliamente distribuido a lo largo de la costa pacífica desde México, hasta los manglares del norte de Perú [6,7]. En Ecuador, es el crustáceo de mayor relevancia comercial explotado artesanalmente [8]; sin embargo, las actividades de extracción de esta especie alteran el hábitat físico del manglar, afectando la topografía y la textura del suelo [9].
Este crustáceo cumple un rol fundamental como macroconsumidor detrívoro-omnívoro, contribuyendo a la recirculación de la materia orgánica y promoviendo la bioturbación del sedimento, sus madrigueras contribuyen a la oxigenación del suelo y aumentan el intercambio de nutrientes suelo-agua, brindando refugios a otros animales [10]. Además, sirve como fuente de alimento para aves, mamíferos, peces y se reafirma como un eslabón en la red trófica de los manglares [11]. A pesar de las normativas vigentes establecidas, la alta demanda de cangrejos puede llevar a una sobreexplotación del recurso, exacerbada por la presión constante de factores como la deforestación, contaminación y cambio de uso de suelo [12].
El Archipiélago de Jambelí se caracteriza por poseer un manglar con alta abundancia biológica, derivada de su diversidad de especies [13]. Este hábitat es esencial para la especie del cangrejo rojo (Ucides occidentalis), ya que proporciona el hábitat necesario para su desarrollo. Sin embargo, el desarrollo de actividades antropogénicas, como la expansión de camaroneras, la sobrepesca y la extracción descontrolada de moluscos y crustáceos ha provocado una pérdida significativa de cobertura de manglar, afectando directamente la disponibilidad de refugio y alimento para la especie [14]. Como consecuencia, la degradación del hábitat altera las condiciones ambientales, como la salinidad, el tipo de sustrato y la disponibilidad de alimento [15, 16, 17].
La morfología del cefalotórax en los cangrejos representa un rasgo funcional de gran relevancia para comprender los mecanismos de adaptación frente a diferentes condiciones ambientales. La proporción largo-ancho del cefalotórax reflejan variaciones genéticas que inciden directamente en el crecimiento y la forma corporal de los individuos [18]. Asimismo, poblaciones que habitan en zonas con distinta temperatura superficial y profundidad presentan diferencias significativas en sus proporciones morfométricas. Estas diferencias estructurales pueden influir en la dinámica poblacional, afectando procesos como la competencia, la reproducción y la supervivencia [19, 16].
La presente investigación evalúa la relación entre datos morfométricos del cangrejo rojo (Ucides occidentalis) y la salud del ecosistema manglar en dos islas del Archipiélago de Jambelí en la provincia de El Oro, Ecuador.
El presente estudio se realizó en la costa sur del Ecuador, dentro de la provincia de El Oro, en el archipiélago de Jambelí, en un rango altitudinal de 0 a 7 msnm, ubicado en las coordenadas de 3°21′56.02" latitud sur y 80°6′38.88" W latitud norte con una extensión de 300 km² (Figura 1) [20]. El archipiélago conformado por un conjunto de islas es una región con gran relevancia ecológica, albergando ecosistemas acuáticos, manglares correspondientes al ecosistema Jama-Zapotillo, así como áreas con intervención humana [21].
Posee una temperatura promedio anual que oscila de 24 a 26 °C y con un bioclima tropical seco que varía entre precipitaciones que van desde los 500 a 1000 mm anuales y termotipo infratropical superior. Debido a su ubicación y características geográficas, cuenta con un suelo salitroso, arenoso, fangoso del manglar [22,23].
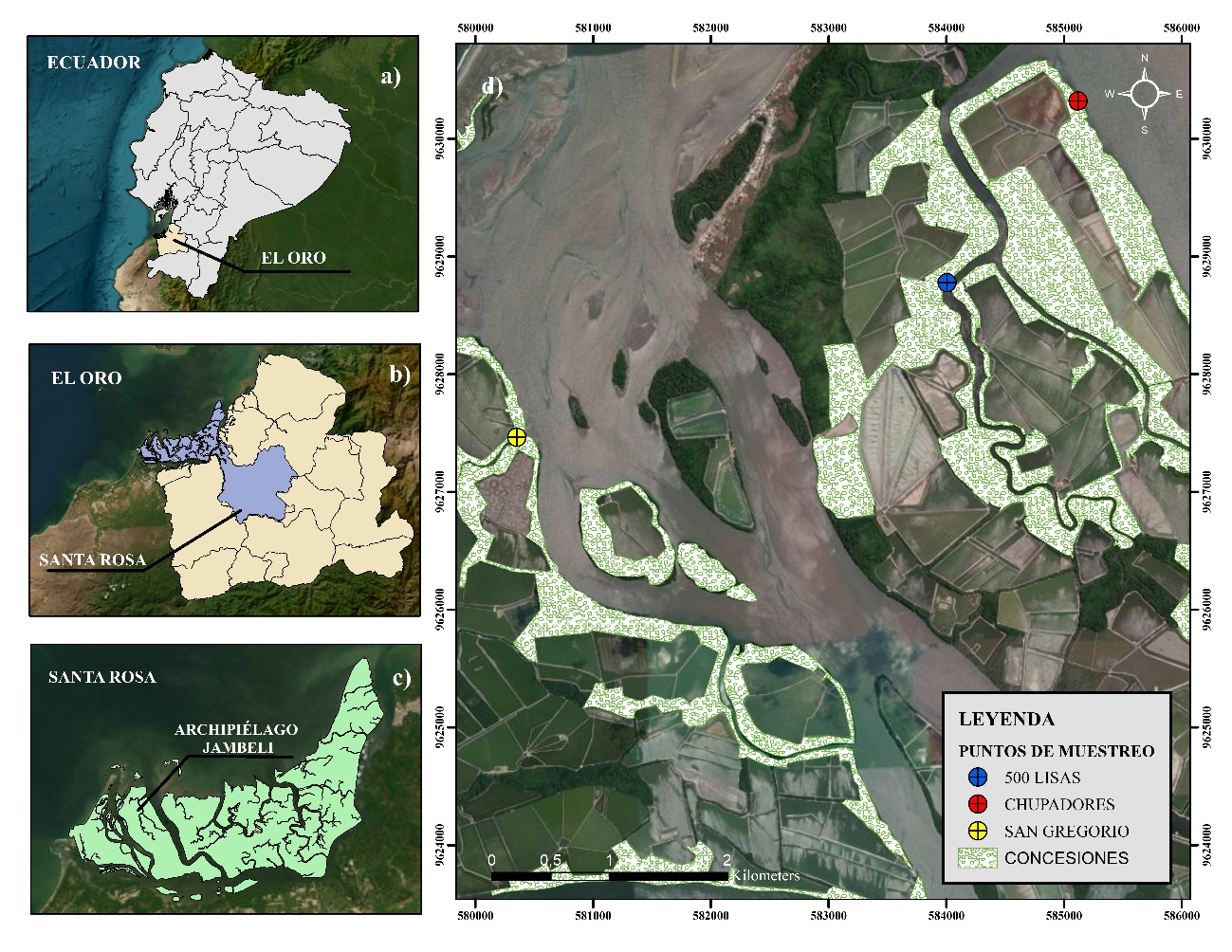
La investigación se realizó en el ecosistema manglar a 30 metros de la orilla, en conjunto de los cangrejeros de la Asociación de Cangrejeros y Anexos 15 de enero, perteneciente a la Cooperativa de Producción Pesquera Artesanal Puerto Hualtaco-Huaquillas, dedicada a la recolección y captura de peces, bivalvos y crustáceos dentro de las concesiones de manglar del Archipiélago de Jambelí [24].
Se seleccionó 3 lugares de capturas en las islas Costa Rica y San Gregorio (Chupadores, San Gregorio y 500 Lisas), las cuales fueron georreferenciadas utilizando la herramienta Handy GPS, como se muestra en la (Tabla 1), y siguiendo la metodología usada por Gonzabay Franco (2024) [25] y modificada para este estudio, se tomó una parcela de 160 m² en cada sitio de captura y dentro de ellas se realizaron 3 transectos separados por una distancia de 10 m cada uno, de 4 metros de ancho y 40 de largo, para la captura y colecta de los individuos, se contó con la ayuda de los cangrejeros experimentados.

Se tomaron datos biométricos solo de cangrejos machos de la especie Ucides occidentalis, en cada uno de los lugares mencionados en la (Tabla 1). Por cada individuo capturado, se midió el ancho y el largo del cefalotórax en milímetros (mm) utilizando un calibrador digital de alta precisión vernier. Posteriormente, se registró la fecha de captura de cada cangrejo, detallando el mes como el día que se realizaron los muestreos, los datos biométricos fueron registrados en una base de datos (Excel) permitiendo tabular de forma detallada la información del tamaño corporal y las características morfométricas de los individuos, contribuyendo a la comprensión de características morfométricas, densidad y variabilidad de la población.
El cálculo de índice multiespectral se realizó utilizando la herramienta de teledetección ArcGIS [26]. Las imágenes satelitales utilizadas en este análisis fueron descargadas del Geoportal del Servicio Geológico de los Estados Unidos (USGS) [27] a través del satélite Landsat 9 OLI-2/TIRS-2 C2 L2, del 2024. Estas imágenes se seleccionaron con un filtro de nubosidad de 10% para minimizar la interferencia atmosférica y garantizar la calidad de los datos del área de estudio. Posteriormente, se realizó la introducción de las 10 bandas preliminares, empleando el cálculo entre la Banda 5 (NIR) y la Banda 4 (RED). El valor del índice de Vegetación de Diferencia Normalizada oscila entre un rango de +1 y –1, donde +1 denota una cubierta vegetal saludable o densa, mientras que –1 señala la ausencia de vegetación o un estado de deterioro. Por lo tanto, se implementó la siguiente ecuación 1:
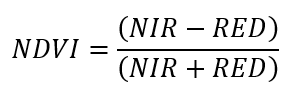
Para la interpretación del índice de vegetación de diferencia normalizada (NDVI), se realizó una clasificación basada en la observación y la escala de colores, fundamentada en el estudio de Patra y Mishra (2024) [28] descritos en la (Tabla 2), facilitando la evaluación en el estado de la salud del manglar durante el año 2024.

El coeficiente de correlación de Pearson es empleado como una medida estadística que mide con exactitud la correlación lineal entre dos variables, mostrando lo intensa es la fuerza en su conexión.
Mediante estos dos conjuntos de datos, X e Y: X = [X1, X2, X3,...Xn] y Y = [Y1, Y2, Y3,...Yn] se calcula el valor de r.
Su rango oscila entre +1 y –1, indicando una relación de conexión directa entre dos elementos. Un valor +1 expresa una relación positiva sólida, por el contrario, un valor –1 señala una relación negativa fuerte, y valores que llegan a cero tienen poca o ninguna relación, de modo que, estos rangos señalan que las estructuras de las muestras pueden ser opuestas [29,30].
El análisis de datos se procesó mediante el programa Python [31], una herramienta ampliamente valorada en el ámbito de la bioestadística ecológica y el procesamiento de datos. Para evaluar la relación entre las variables morfométricas del caparazón (ancho y largo), se aplicó el coeficiente de correlación de Pearson, que continúa en un heatmap a través de las librerías (matplotlib y seaborn) [32]. Este método permitió cuantificar tanto la intensidad como el sentido de dicha relación, aportando información clave sobre la conexión entre variables analizadas. Así mismo, se empleó el diagrama box plot, para comprobar las diferencias entre las estaciones climáticas (seca, lluviosa) para examinar las discrepancias en el tamaño de los cangrejos de acuerdo a su sitio de muestreo.
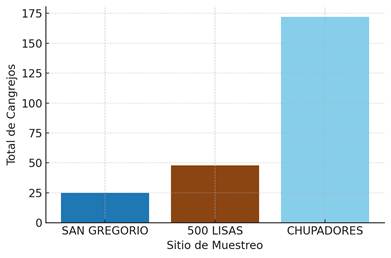
En la (Figura 2) se muestra una marcada variación en la abundancia de machos de Uccides occidentalis capturados en los sitios de muestreo: San Gregorio, 500 Lisas y Chupadores. Considerando que la captura de la especie se realizó en colaboración con la Asociación de Cangrejeros 15 de enero y que los datos fueron registrados del año 2024, se recolectaron 243 especímenes machos de esta especie de captura comercial.
Se evidencia que el lugar Chupadores registró mayor abundancia, con 173 individuos, con un total del 70,6% recolectado, en cambio, 500 Lisas presentó una cantidad de 48 individuos, teniendo un 19,5% recolectado, mientras que San Gregorio mostró la menor cantidad de captura con 24, con el 9,8% del total de cangrejos. De acuerdo con nuestros resultados, en el estudio de Hernandez Cantero (2022) [33] realizada al noreoeste de Colombia, se evidencia que se totalizó 287 individuos del cangrejo C. guanhumi, indicando que el valor más alto de individuos fue de 78.3%. Mientras que, el estudio de Zambrano y Olivares (2020) [34] registrado en la costa continental norte del Ecuador, indica que el total de individuos recolectados procedente de la captura comercial del cangrejo Cardisoma crassum, se obtuvieron 663 individuos, destacando que existe una mayor presencia de machos con 512; este patrón indica que la población puede verse afectada por factores ecológicos, como la competición por espacio y recursos. Cannicci et al (2018) [35] establecen que los ecosistemas de manglares, en algunas especies, pueden dominar la alimentación de hojas de manglar, explicando que el comportamiento agresivo denominada como segregación espacial determina que, especies menos competitivas llegan a desplazarse a áreas menos favorables. En este caso, en el sitio Chupadores se observa que algunos individuos de U. occidentalis pueden ser más competitivos y concentrarse en áreas más ricas en recursos, mientras que los otros lugares como San Gregorio y 500 Lisas esta misma especie podría desplazar a otros individuos a zonas con menos recursos.
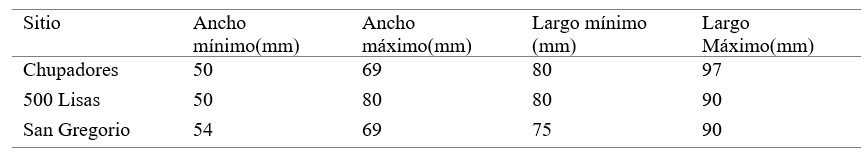
En Chupadores hay una concordancia precisa entre los rangos dimensionales de la población en general, para este lugar, el ancho de cefalotórax mínimo fue de 50 mm y el ancho máximo de 69 mm, largo mínimo de 80 mm y el largo máximo de 97 mm; en 500 Lisas el ancho mínimo fue de 50 mm y el ancho máximo de 80 mm y el largo mínimo de cefalotórax fue 80 mm y el largo máximo fue de 90 mm; mientras que en San Gregorio el ancho mínimo fue de 54 mm y el ancho máximo de 69 mm y el largo mínimo fue de 75 mm y el máximo. (Tabla 3)
De acuerdo con el estudio de Vega (2018) [36] en el Pacifico de Panamá, Cardisoma crassum y de Ucides Occidentalis definió que los cangrejos machos tienen mayor tamaño, con un promedio de 72.3 mm. Por otro lado, Zambrano y Meiners (2018) [37] en su estudio mencionan tallas observadas en el Golfo de Guayaquil de 142 mm de AC en cangrejos machos y sugieren una heterogeneidad entre tallas y que las diferencias significativas entre los tamaños pueden vincularse a la etapa de madurez sexual y competencia entre recursos.
El análisis de la relación entre la longitud y el ancho de cefalotórax se llevó a cabo para la totalidad de los individuos estudiados. Se presenta una correlación positiva de intensidad débil, pero estadísticamente significativa (r= 0.32, p < 0.001) entre ambas variables, según el coeficiente de correlación de Pearson, una relación estadísticamente significativa. En términos biológicos, este hallazgo sugiere una tendencia incipiente: a medida que el ancho del cefalotórax aumenta, se presenta una mayor longitud [38,39].
Sin embargo, Sahu et al (2024) [40] mencionan que el aumento en el ancho del cefalotórax está asociado con un incremento proporcional en el peso corporal y no en su longitud. Es importante señalar que, si bien la relación es positiva, su magnitud no indica una linealidad consistente. La significancia estadística obtenida subraya que esta correlación no es atribuir al azar y podría ser modulada por variables intrínsecas como la edad, el sexo y la condición física, así como por factores extrínsecos como el ambiente local [41], [42]. Estos resultados concuerdan con el estudio de Dvoretsky y Dvoretsky (2020) [43], observando que la abundancia y biomasa (Peso total de la población) de cangrejos juveniles se correlacionó positivamente con la temperatura del agua entre los meses de septiembre y octubre, lo contrario con la temperatura del mes de diciembre.
La existencia de este patrón de correlación morfométrica no es un hallazgo aislado, observándose en casos similares con otras especies de cangrejos, como Ucides cordatus y Goniopsis cruentata [42]. Gilby et al (2020) [44] describen que, en estas especies, las dimensiones corporales también tienden a estar relacionadas, aunque la fuerza de esa asociación puede variar según el entorno o la presión pesquera local como la interacción sinérgica de la disponibilidad de recursos y complejidad del hábitat.
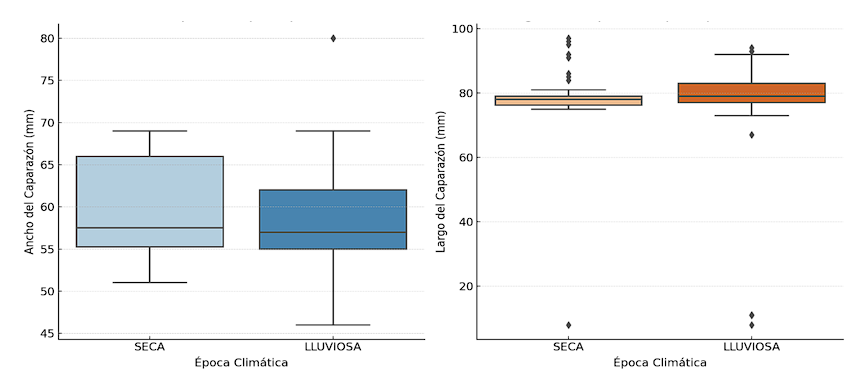
Las tallas de los cangrejos fueron analizadas en función de las capturas realizadas en dos temporadas clave: la época lluviosa y la época seca (Figura 3). Los resultados del primer diagrama de cajas para la época lluviosa mostraron una mediana de talla consistente, pero con una mayor dispersión de los datos. Esta amplitud en el rango de tallas sugiere una variabilidad inusual en el tamaño de los individuos, posiblemente vinculada a condiciones ambientales que estimulan un crecimiento diferencial [45]. Se determinó que la longitud promedio del caparazón en este periodo fue de unos 75 mm, indicando una tendencia a tallas más reducidas durante esta época, concordando con lo mencionado por Schwamborn y Moraes-Costa (2020) [46], indicando una diferencia en la variación de la media del ancho de caparazón, siendo inferior en estaciones lluviosas. Esta observación podría relacionarse con condiciones ambientales específicas de la época lluviosa, tales como inundaciones, cambios en la disponibilidad de alimento, condiciones pluviométricas, temperatura, concentración de materia orgánica o las variaciones en la salinidad [47].
En contraste, los datos obtenidos durante la época seca (junio-diciembre) mostro una mayor cohesión en las medidas de ancho del caparazón, evidenciando una menor variabilidad en las tallas. El tamaño promedio observado fue de 65 mm, con un rango de distribución entre 55mm y 70mm, indicando una población más uniforme durante esta temporada. La longitud del caparazón alcanzó los 80mm, presentando una distribución más estable y compacta, lo que indica que la mayoría de los individuos mantienen un tamaño promedio durante esta época. Estos resultados se relacionan con lo reportado por Campo et al (2015) [48] quienes también observaron un incremento de tallas respecto a la longitud del caparazón durante la transición entre época lluviosa y seca, posiblemente debido a una mayor disponibilidad de alimento. Demostrando que los individuos muestreados en los meses de septiembre y octubre (época seca) presentaron los tamaños promedios más grandes (12.36 cm), mientras que los individuos muestreados en los meses de febrero y marzo (época lluviosa) presentaban tallas menores (11 cm) de largo de cefalotórax.
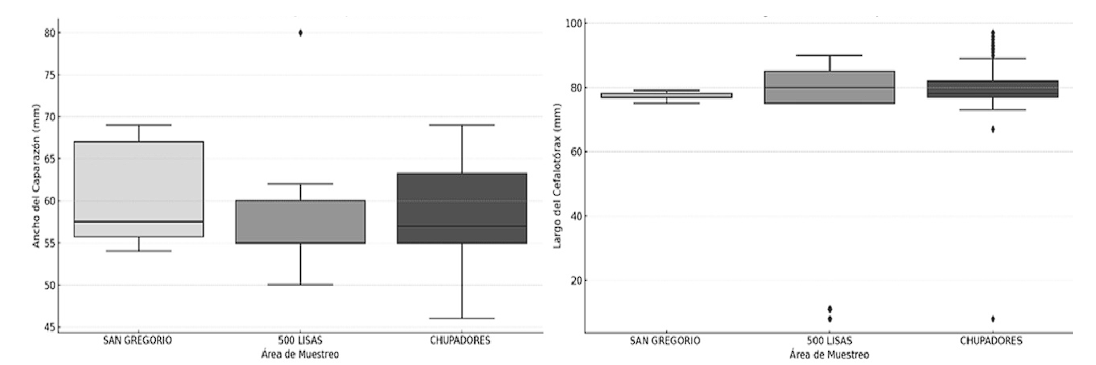
El diagrama de cajas (Figura 4) de la distribución del ancho de caparazón por sitios de muestreo, a diferencia del largo. Chupadores es el lugar que muestra el promedio más alto con 7 mm de promedio. Por otro lado, San Gregorio presenta una mediana de 65 mm de AC y una distribución más consistente, debido a que los cangrejos de esta área tienen menor variabilidad en su tamaño; 500 Lisas presenta una mediana inferior a los 62 mm de ancho y presentan distribución más homogénea en cuanto al tamaño de los cangrejos.
Comparando los promedios de largo de cefalotórax, se presentó que los tres sitios tienen un promedio de 80 mm. Sin embargo, San Gregorio muestra una distribución más uniforme y con menor variabilidad en el tamaño del largo del cefalotórax de los cangrejos, lo que indica una relación más homogénea en este aspecto como lo muestra la (Figura 4); el sitio 500 Lisas por otro lado presenta mayor distribución y variabilidad en el tamaño de longitud del cefalotórax. Finalmente, Chupadores presenta mayor dispersión con valores relativamente atípicos con outliers, lo que implica que este sitio alberga cangrejos que varían mucho más en tamaño, en comparación con los otros sitios.
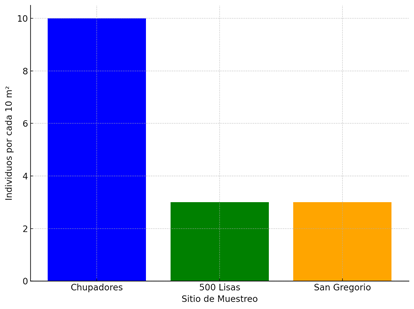
En la Figura 5 se muestra la densidad poblacional de cangrejos en individuos en los tres sitios de muestreo, considerándose a partir de 160 m2 debido a la adaptabilidad del estudio de transecto de captura en cada sitio.
El sitio Chupadores presentó la mayor densidad poblacional, con un aproximado de 10 ind por cada 10 m2, o que se sugiere que las condiciones ambientales del sitio favorecieron una mayor concentración de individuos, indicando a posibles mejores condiciones para esta especie y de captura, en contraste con 500 Lisas presento una densidad intermedia de 3 ind por cada 10/m2, lo que indica que las condiciones de este sitio son favorables para mantener una población estable de cangrejos, aunque también permiten una captura moderada sin afectar significativamente la abundancia. Por último, San Gregorio tuvo una densidad más baja, con 3 ind por cada 10 m2, teniendo menos concentración de individuos pero que puede mantener una concentración. Teniendo que en el estudio de Hernández Cantero (2022) [34], obtuvieron datos similares con resultados de 3 ind/ por cada 10 m2.
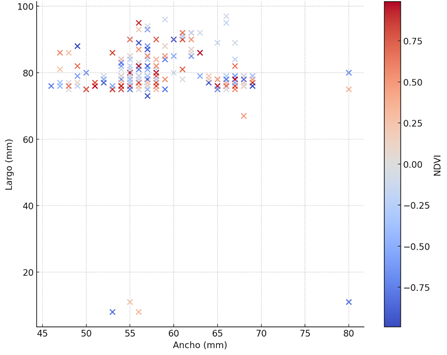
Con los datos de la Figura 6, se ilustra la relación entre los valores de NDVI y las dimensiones del ancho y largo del cefalotórax de los cangrejos, permitiendo evaluar la salud en la vegetación mediante la asociación de puntos con los índices NDVI. De acuerdo con representación, se implementó la interpretación del rango establecido en la (Tabla 2). Se detecto que los valores de NDVI oscilaron entre aproximadamente +0,75 y –0,75. Valores cercanos a +0,75 (color rojo), indica una vegetación densa y saludable, es decir, cobertura vegetal vigorosa y funcional. Según el estudio de Huang et al(2021) [49] mencionan que valores positivos altos suelen asociarse con una vegetación vigorosa (> 0,5) mientras que valores cercanos a 0 representan superficies con poca vegetación o estructuras débiles, y valores negativos están típicamente vinculados a vegetación muerta, lo que coincide con que los cangrejos de esas áreas presentan mayores tamaños corporales (en un rango de 0,66 a 1) por lo que tienden a ser más grandes en su tamaño, variando entre 60 mm y 75 mm, favoreciendo a su crecimiento. Los valores cercanos a 0,50 (color azul y naranja claro) corresponden una vegetación saludable (en un rango 0,33 a 0,66) lo que refleja que los cangrejos de estas áreas son de tamaño medio que, en áreas con vegetación escasa, teniendo un ancho de 55 mm y 60 mm y largo de 70 mm y 80 mm, por lo que las condiciones son favorables, pero no tan optimas. Por otra parte, valores cercanos a 0 (color azul claro) ubicados en un rango 0 a 0,33, refleja una vegetación no saludable, con un ancho de 50 mm y 55 mm y un largo de 60 a 70 mm. Finalmente, los valores –0,75 con un color azul se asocian a zonas con vegetación muerta o agua (en el rango –1 a 0) teniendo un entorno menos favorable, su ancho fue de 50 mm y el largo oscila entre 50 a 60 mm, por lo que son más pequeños de tamaño, reflejando la falta de vegetación en su crecimiento. Además, mediante la observación visual del área del NDVI en ArcGIS, el sitio San Gregorio está representada en su mayoría por la expansión camaronera, teniendo pequeñas áreas de vegetación, a diferencia de los sitios 500 Lisas y Chupadores que presenta áreas más grandes de vegetación, pero así mismo está cubierta en su mayoría por camaroneras, esto revela que estos dos sitios son más propensos a ser sobreexplotados. Demostrando que los que habitan en áreas con vegetación más saludable logran ser que su tamaño sea más grande, en cambio los que pueden habitar en áreas con una vegetación poco saludable serán más pequeños.
Los resultados evidenciaron una marcada variación en la abundancia de los cangrejos entre los tres sitios de muestreo. En Chupadores, se registró la mayor densidad, con 10 ind cada 10/m2 lo que sugiere que este sitio ofrece condiciones ecológicas más favorables para el desarrollo de la especie, posiblemente asociadas a una mayor cobertura vegetal, disponibilidad de alimento y calidad del sustrato; por otro lado, en San Gregorio, la densidad fue considerablemente más baja, con 3 ind cada 10/m2 indicando un entorno menos favorable. Además, se observó que en el sitio Chupadores presentaban un tamaño mayor en el cefalotórax, con medidas que oscilaban entre 50 mm y 69 mm de ancho y entre 80 mm y 97 mm de largo. En contraste, en el sitio 500 Lisas se registraron tallas superiores, mientras que en San Gregorio se evidenció una menor variabilidad en el tamaño. La relación entre el ancho y la longitud del caparazón mostró una correlación positiva, aunque débil (r = 0,32, p < 0,001), lo que sugiere que, a medida que aumenta el ancho, también lo hace la longitud, pero no presenta normalidad. Durante la época lluviosa, la variabilidad en el tamaño fue mayor, mientras que, en la época seca, los tamaños fueron más homogéneos.
La relación entre las dimensiones del cefalotórax y el índice de vegetación NDVI mostró que los valores cercanos a +0,75 están asociados con áreas de vegetación saludable y tamaños más grandes de cangrejos, mientras que valores cercanos a -0,75 se relacionan con vegetación degradada y tamaños más pequeños. Al analizar los datos del NDVI en QGIS, se observó que San Gregorio se caracteriza por la expansión de las camaroneras, con áreas limitadas de vegetación, a diferencia de 500 Lisas y Chupadores, que cuentan con áreas más amplias que, aunque parcialmente cubiertas por camaroneras, siguen concentrando individuos de U. occidentalis. Esto sugiere que las condiciones ambientales, como la cobertura vegetal, influyen en la abundancia y densidad de la especie.
Estos hallazgos resaltan la importancia crítica de la conservación de los manglares, los cuales brindan valiosos servicios ecosistémicos. Un ecosistema saludable podría favorecer la abundancia de U. occidentalis, mientras que la degradación de estos hábitats podrían causar efectos negativos sobre la densidad y el tamaño de los cangrejos.
Los autores expresan no existir conflictos de intereses para esta obra de investigación.
Los autores expresan autofinanciamiento para realizar esta obra de investigación
Autor Principal 35%: Escritura, Gestión, Recursos y Tecnología, Investigación Coautor 1: 35%: Escritura, Gestión, Recursos y Tecnología, Investigación Coautor 2: 25% Escritura, Gestión, Investigación Coautor 3: 5% Escritura, Gestión, Investigación
© 2025 Marcela Elizabeth Robles Zambrano, Gabriela Paola Granda Cevallos, Alex Dumany Luna-Florin y Lissette Noheli Ramírez Moreira

Artículo de libre acceso bajo los términos de una
Licencia
Creative Commons Reconocimiento – NoComercial – CompartirIgual 4.0
Internacional.
Se permite, sin restricciones, el uso, distribución, traducción y reproducción del
documento,
siempre y
cuando
se realice sin fines comerciales y estén debidamente citados bajo la misma licencia.